ТЕМА 1. Будова атома. Періодичний закон » §15 Впр.4(б)
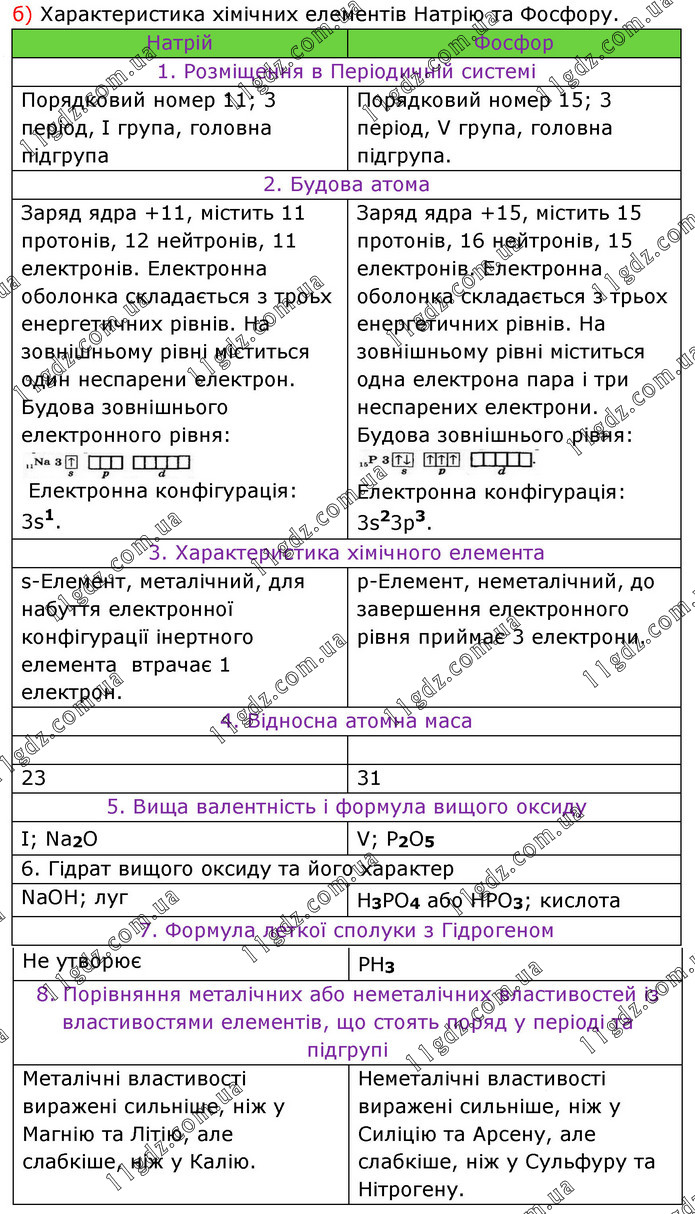
б) Характеристика хімічних елементів Натрію та Фосфору. Натрій Фосфор 1. Розміщення в Періодичній системі Порядковий номер 11; 3 період, І група, головна підгрупа Порядковий номер 15; 3 період, V група, головна підгрупа. 2. Будова атома Заряд ядра +11, містить 11 протонів, 12 нейтронів, 11 електронів. Електронна оболонка складається з троьх енергетичних рівнів. На зовнішньому рівні міститься один неспарени електрон. Будова зовнішнього електронного рівня: Електронна конфігурація: 3s1. Заряд ядра +15, містить 15 протонів, 16 нейтронів, 15 електронів. Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься одна електрона пара і три неспарених електрони. Будова зовнішнього рівня: Електронна конфігурація: 3s23p3. 3. Характеристика хімічного елемента s-Елемент, металічний, для набуття електронної конфігурації інертного елемента втрачає 1 електрон. р-Елемент, неметалічний, до завершення електронного рівня приймає 3 електрони. 4. Відносна атомна маса 23 31 5. Вища валентність і формула вищого оксиду I; Na2O V; P2O5 6. Гідрат вищого оксиду та його характер NaOH; луг H3PO4 або HPO3; кислота 7. Формула леткої сполуки з Гідрогеном Не утворює РН3 8. Порівняння металічних або неметалічних властивостей із властивостями елементів, що стоять поряд у періоді та підгрупі Металічні властивості виражені сильніше, ніж у Магнію та Літію, але слабкіше, ніж у Калію. Неметалічні властивості виражені сильніше, ніж у Силіцію та Арсену, але слабкіше, ніж у Сульфуру та Нітрогену.